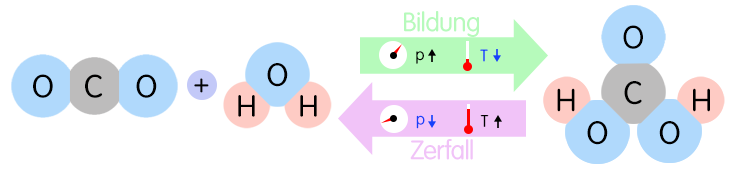
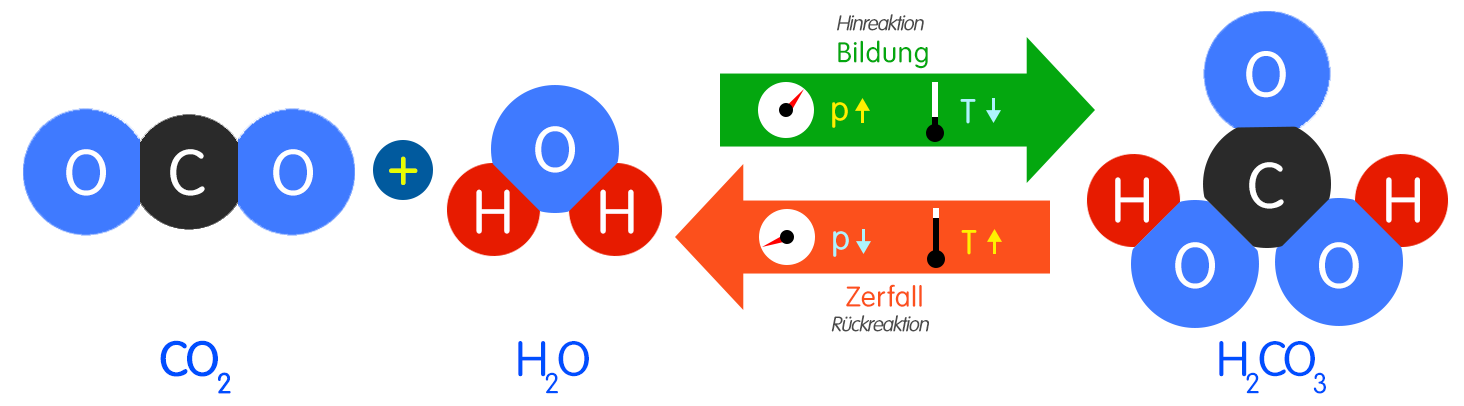
chemische Reaktion von Kohlenstoffdioxid mit Wasser [umkehrbare chemische Reaktion; chemisches Gleichgewicht zwischen Hinreaktion und Rückreaktion]:
CO2 (g) + H2O (l) →← H2CO3 (l) ; ΔH = –20,37 kJ · mol–1
CO2 (g) + H2O (l) →← H2CO3 (l) ; ΔH = –20,37 kJ · mol–1