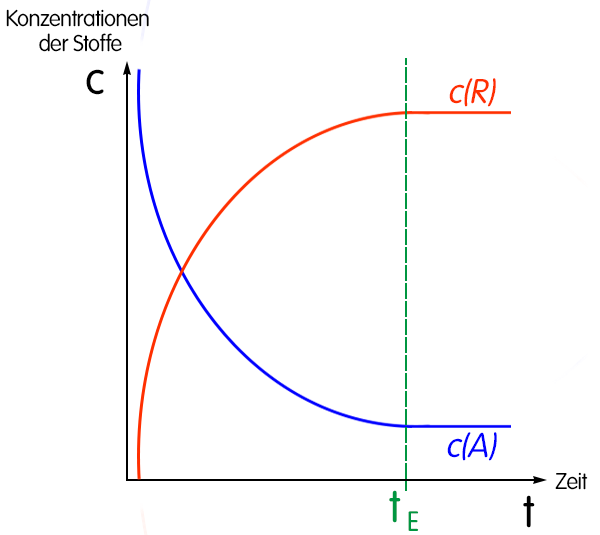
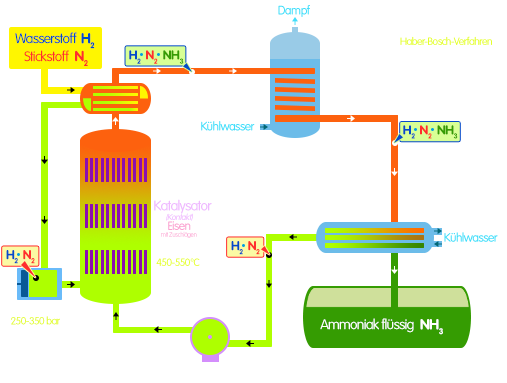
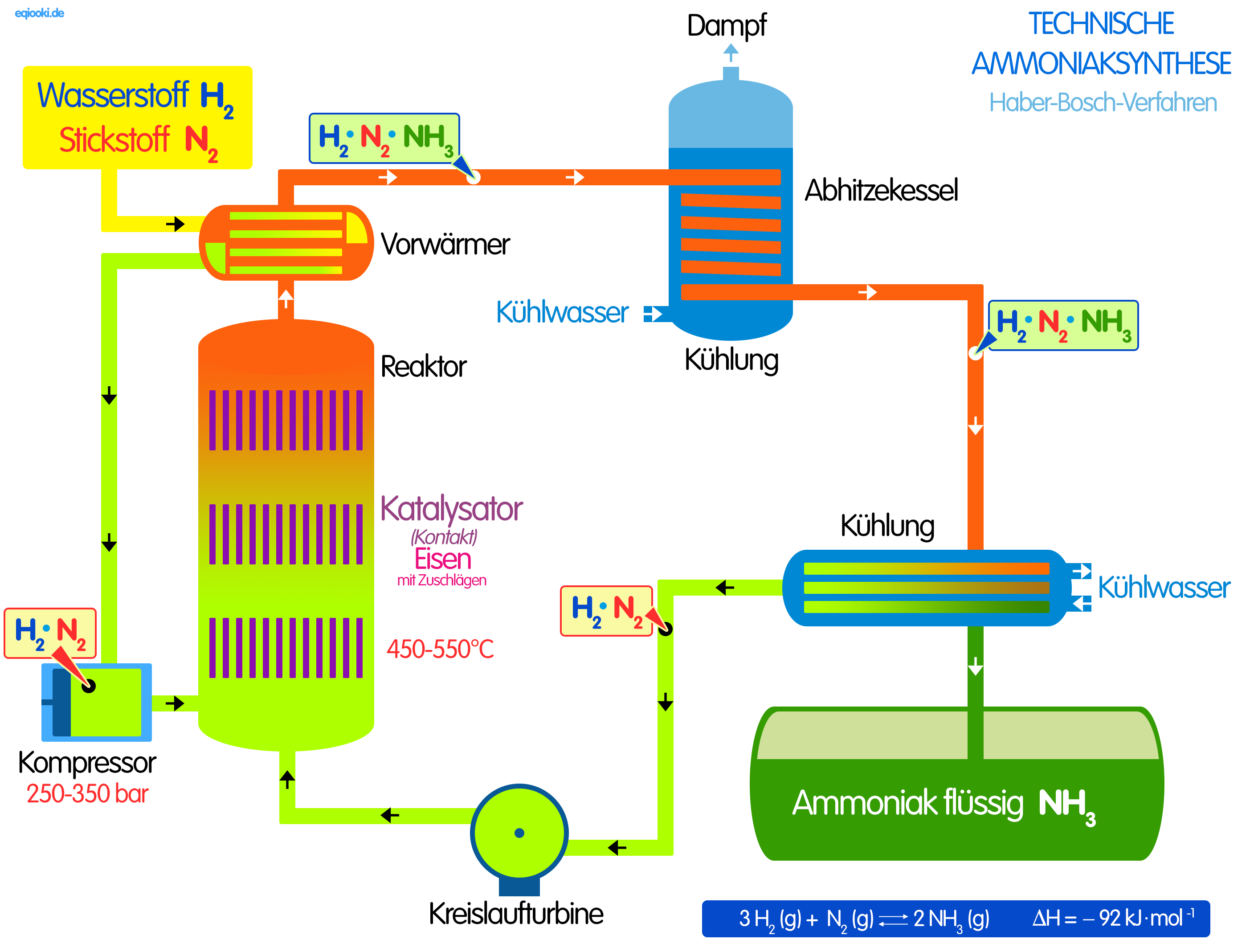
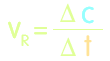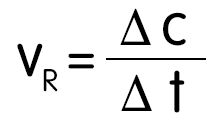- Eine chemische Reaktion verläuft umso schneller, je größer die Änderung der Konzentration in einer bestimmten Zeit ist. Die Reaktionsgeschwindigkeit ist der Quotient aus der Konzentrationsänderung in der dafür benötigten Zeitspanne.
- Die Änderung der Reaktionsbedingungen [Temperatur, Druck, Zerteilungsgrad] bewirkt eine Änderung der Reaktionsgeschwindigkeit.