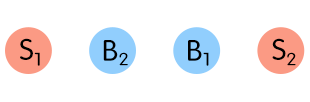
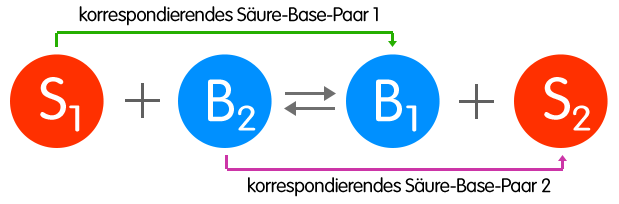
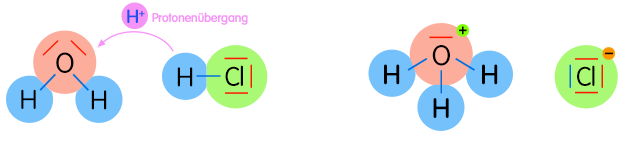
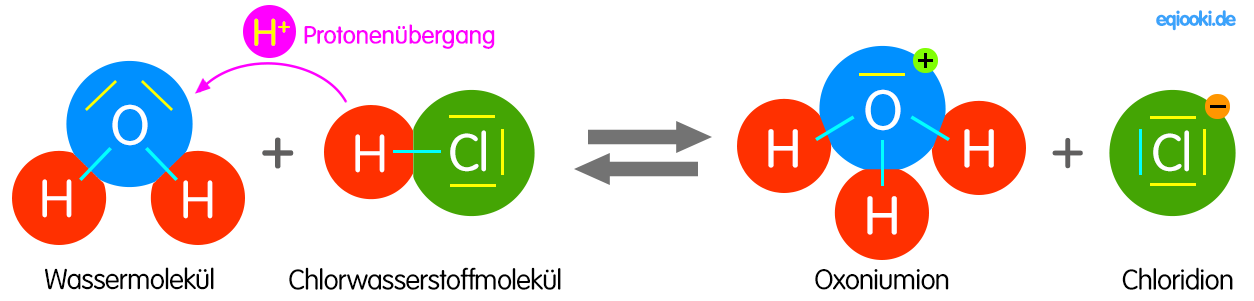
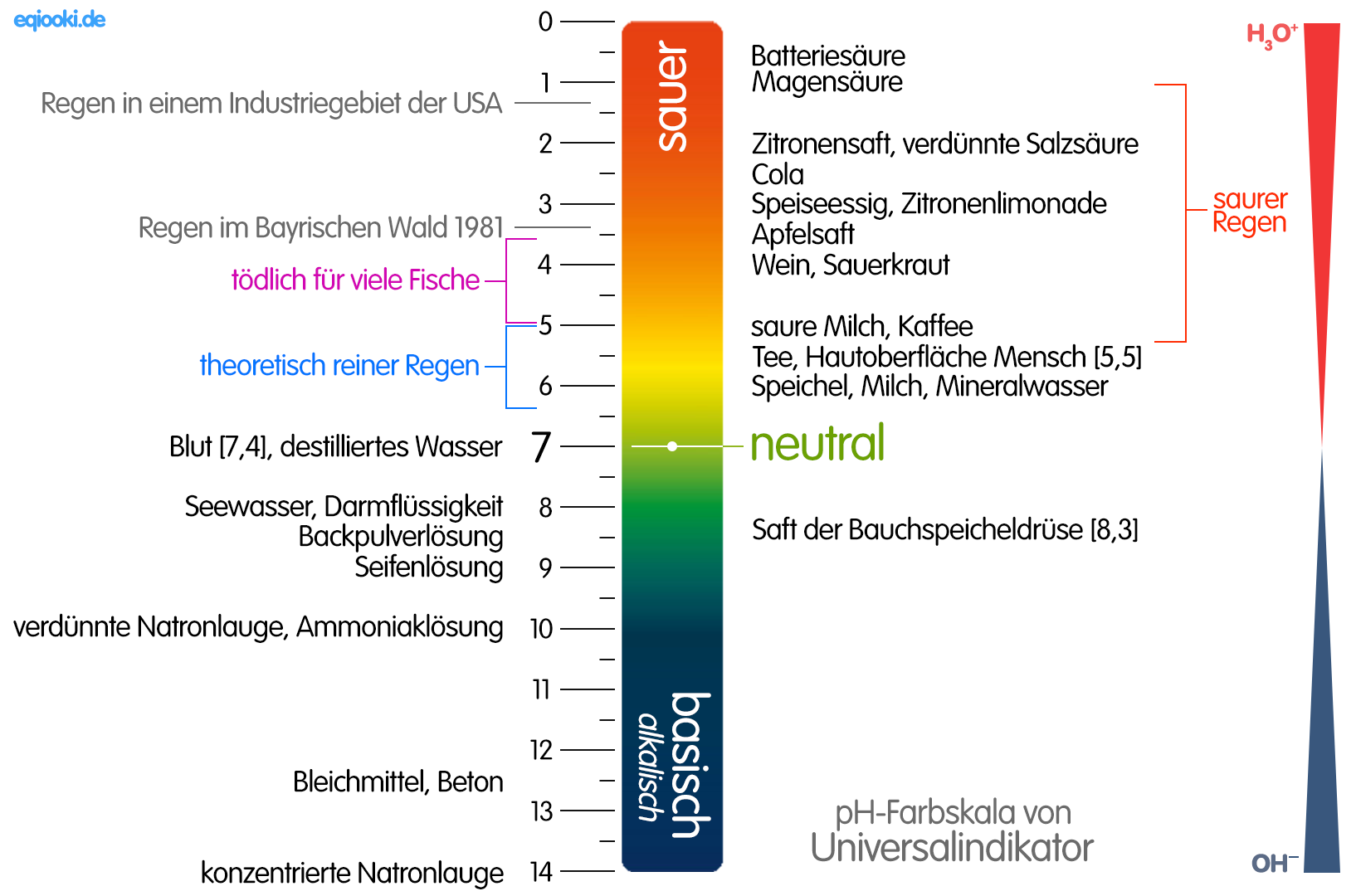
Bei einer Säure-Base-Reaktion [Protolyse] existieren zwei korrespondierende Säure-Base-Paare, die miteinander in Wechselwirkung treten; dabei entsteht aus Säure 1 infolge Protonenabgabe die Base 1 und durch Aufnahme der Protonen aus Base 2 die Säure 2.